Sommaire
Définition
Les combustibles sont multiples (gaz, pétrole, bois, charbon, …) mais ils ont un point commun : celui de contenir principalement des hydrocarbures, c’est-à-dire des combinaisons multiples de carbones et d’hydrogènes. La composition des combustibles peut être représentées par la formule générique :
C Hy Ox
soit pour un atome de carbone (C), on trouve en moyenne “y” atomes d’hydrogène (H) et “x” atomes d’oxygène (O).
| Combustible | Composition générique typique |
|---|---|
| Biomasse | C H1.44 O0.66 |
| Charbon (tourbe) | C H1.2 O0.5 |
| Charbon (anthracite) | C H0.4 O0.02 |
| Pétrole | C H1.8 |
| Gaz | C H3.75 … C H3.95 |
Par exemple, le CH4, appelé méthane, est le constituant principal du gaz naturel (entre 83 % et 88 % en volume). Un litre de fuel, est, quant à lui, constitué d’environ 726 gr de carbone (C), 110 gr d’hydrogène (H) et 2 gr de soufre (S). De manière générale, on constate qu’il y a plus d’oxygène dans la biomasse que dans les combustibles fossiles.
Produits de la combustion
En effet, si on considère la combustion “stoechiométrique” (c’est-à-dire contenant la quantité d’oxygène exacte pour faire réagir le combustible de manière parfaite), on obtient,
CHyOx + (1 + y/4 – x/2) O2 —› CO2 + y/2 H2O
Par exemple, on obtient pour le méthane
CH4 + 2 O2 —› CO2 + 2 H2O
C’est le CO2 dont on parle au niveau de la pollution atmosphérique et de la problématique du réchauffement de la planète qu’il entraîne. Il est principalement lié à l’utilisation des combustibles fossiles, elle-même liée à l’activité économique. Voici 2>les ordres de grandeur du CO2 produit.
| Production de CO2 lors de la combustion de (on peut estimer grossièrement qu’au niveau valeur énergétique, 1 m³ de gaz = 1 litre de fuel) : |
|
| 1 m³ de gaz | 2 kg CO2/m³ |
| 1 litre de fuel | 2,7 kg CO2/litre |
Les fumées en sortie de chaudière contiendront également de la vapeur d’eau (H2O).
| Production de H2O lors de la combustion de | |
| 1 m³ de gaz | 1,68 kg/m³ |
| 1 litre de fuel | 0,9 kg/litre |
Mais l’oxygène provient de l’air atmosphérique et celui-ci contient également de l’azote (N), qui théoriquement reste neutre dans la réaction de combustion et devrait être rejeté comme tel dans les fumées. Cependant, sous certaines conditions de combustion, cela n’est pas le cas. En effet, l’azote se combine avec l’oxygène pour former des oxydes d’azote NO, NO2, N2O,… rassemblés sous la dénomination NOx. Ceux-ci sont en partie responsables des pluies acides.
Les combustibles contiennent également des traces d’autres éléments dont la combustion est nocive pour l’environnement. Le principal est le soufre dont l’oxydation fournira du SO2 et du SO3. Ce dernier formera de l’acide sulfurique par combinaison avec de l’eau (par exemple, lors du contact entre les fumées et les nuages). C’est ce qui entraîne aussi la formation de pluie acide.
Si le gaz naturel ne contient pratiquement pas de soufre, le mazout et le charbon sont à ce niveau assez polluants et la réglementation vise à abaisser la teneur en souffre maximale autorisée.
En résumé, les produits de la combustion sont principalement constitués de CO2, d’H2O, de NOx et de SOx.
Quantité d’air nécessaire
La quantité d’air nécessaire pour brûler 1 m³ ou 1 litre de combustible dépendra des caractéristiques de celui-ci. Mais il est bon d’avoir en tête un ordre de grandeur.
“La combustion 1 m³ de gaz naturel ou d’1 litre de fuel requiert environ 10 m³ d’air à 15°C”
À cette quantité “stoechiométrique”, c’est-à-dire requise par l’équation chimique de la combustion, s’ajoute un léger excès d’air pour s’assurer que toutes les molécules de combustible soient bien en contact avec l’oxygène. En effet, il faut prévoir que certaines molécules d’oxygène vont traverser le foyer sans se lier au combustible. Dit autrement, il faut éviter d’avoir des zones, des poches, où le processus de combustion viendrait à manquer localement d’oxygène.
On travaille donc avec un excès d’air comburant qui s’élève par exemple pour la combustion du fuel à environ 20 %. Il faut donc prévoir 12 m³ d’air pour brûler 1 litre de fuel.
Lorsqu’une combustion se fait avec une arrivée insuffisante d’oxygène, on parle de combustion incomplète. Celle-ci se traduit par la production d’imbrûlés (suies qui encrassent la chaudière) ou d’éléments partiellement oxydés, pouvant encore brûler, comme le monoxyde de carbone (CO).
| Le CO est un gaz très dangereux : il est inodore, il passe dans le sang, se fixe sur l’hémoglobine à la place de l’oxygène et empêche le transport de celui-ci jusqu’aux cellules. Une teneur de 0,2 % de CO dans l’air entraîne la mort en moins d’une demi-heure … |
La figure suivante montre l’évolution de la composition des fumées en fonction de l’excès d’air dans le cas d’une combustion à prémélange (d’air et du combustible). On constate qu’en présence d’un manque d’oxygène, il y production de CO. Lorsque l’excès d’air augmente au-delà d’une certaine valeur, la teneur en CO2 des fumées diminue par dilution, dilution qui diminue le rendement de combustion dans la mesure où les fumées ont une température plus basses.
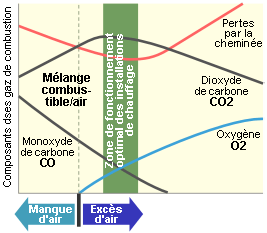
Evolution du contenu des fumées avec l’excès d’air [%] de combustion : cas de la combustion avec prémélange air-combustible (par exemple mélange d’air et de gaz naturel).
Le pouvoir calorifique d’un combustible
Généralités
Le pouvoir calorifique d’un combustible est la chaleur que peut dégager la combustion complète d’une unité de combustible. Dans le milieu scientifique, on l’exprime souvent en kJ/kg de combustible. Néanmoins, suivant le domaine d’application, on peut l’exprimer dans d’autres unités plus pratiques, par exemple, en kWh/m³ pour le gaz ou kWh/litre pour le fuel.
Dans les produits de la combustion, il y a de la vapeur d’eau, issue de la réaction de l’hydrogène du combustible. Dans certains appareils de combustion, l’eau reste à l’état de vapeur et s’échappe dans cet état vers la cheminée. La chaleur nécessaire pour vaporiser l’eau est donc perdue. Au contraire, certains appareils permettent de condenser l’eau et de récupérer l’énergie dégagée par l’eau pendant son changement de phase. On pense typiquement aux chaudières dites à condensation qui utilisent ce procédé pour augmenter leur rendement.
Sur base de cette distinction, on définit deux pouvoirs calorifiques :
- Le pouvoir calorifique inférieur (PCI ou Hi), mesuré en conservant l’eau à l’état vapeur,
- Le pouvoir calorifique supérieur (PCS ou Hs), mesuré après avoir récupéré la chaleur de condensation de l’eau.
Cas des combustibles “purs”
Exemples :
- Le gaz “riche” algérien présente un PCI d’environ 36 MJ/m³N et un PCS d’environ 40 MJ/m³N.
- Le fuel présente un PCI d’environ 36 MJ/litre et un PCS d’environ 39 MJ/litre.
| PCI du combustible | ||||
|
Vecteur |
Unité | en MJ | (en kWh) | (en Wh) |
| Gaz naturel pauvre | m³ | 32,97 | 9,16 | 9 160 |
|---|---|---|---|---|
| Électricité | kWh | 3,6 | 1 | 1 000 |
| Gaz butane | kg | 45,56 | 12,66 | 12 660 |
| Gaz naturel riche | m³ | 36,43 | 10,12 | 10 120 |
| Houille | kg | 29,3 | 8,14 | 8 140 |
| Anthracite 10/20 | kg | 31,4 | 8,72 | 8 720 |
| Coke | kg | 28,5 | 7,92 | 7 920 |
| Propane | L | 23,72 | 6,59 | 6 590 |
| Gasoil chauffage | L | 35,87 | 9,96 | 9 960 |
| Fuel léger | L | 36,37 | 10,10 | 10 100 |
| Fuel moyen | L | 37,68 | 10,47 | 10 470 |
| Fuel lourd | L | 38,16 | 10,60 | 10 600 |
| Fuel extra lourd | L | 38,58 | 10,72 | 10 720 |
On peut déduire le PCI par unité de masse d’un combustible pur caractérisé par la composition CHyOx par la formule expérimentale suivante exprimée en MJ/kg :
PCI = enthalpie de réaction / masse molaire = [(393.6 + 102.2 y – (110.6 + 204.4 y) x ) / (1 + y)] / [12 + y + 16 x] en [MJ/kg]
Cette formule est d’application pour tous les combustible, qu’ils soient fossiles ou issus de la biomasse. Néanmoins, il donne l’énergie pour un combustible pur (c’est-à-dire non dilué par un agent supplémentaire comme de l’eau).





[…] latente. Si on est capable de récupérer cette énergie, on parlera du pouvoir calorifique supérieur (PCS). Par contre, si, dans la phase de récupération de l’énergie des […]