Sommaire

Principes fondamentaux de l’osmose et de l’osmose inverse
L’osmose
Au même titre qu’un caillou ne peut évoluer que d’une altitude plus élevée vers une altitude plus basse (différence de potentiel), un système chimique évoluera naturellement d’une enthalpie libre (rôle du potentiel) plus élevée vers une plus faible (premier principe de la thermodynamique). L’enthalpie libre d’un système chimique constitué d’un solvant (l’eau de ville à traiter) et de solutés (sel minéraux, matières organiques, …) est fonction de la concentration de chacun de ses constituants: le potentiel d’une solution saline est plus élevé que celui d’une solution moins saline.
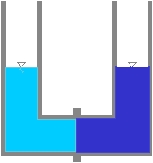
Eau “pure”.
Eau + soluté.
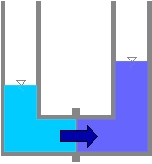
Migration de l’eau.
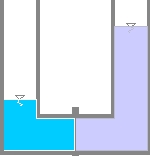
Équilibre osmotique.
Si les deux solutions sont mises en contact par l’intermédiaire d’une membrane semi-perméable, les solutés (les sels) de la solution la plus concentrée ne pouvant la traverser, c’est le solvant (l’eau) de la solution la moins concentrée qui la traversera afin de réduire l’enthalpie libre et ce jusqu’à ce que le système soit en équilibre. Cet équilibre est atteint quand la différence de hauteur entre les deux solutions correspond à la pression osmotique (correspondance des deux concentrations de part et d’autre de la membrane).
La valeur de la pression osmotique est principalement fonction des solutés présents dans la solution (potentiel chimique) et de leur concentration.
L’osmose inverse
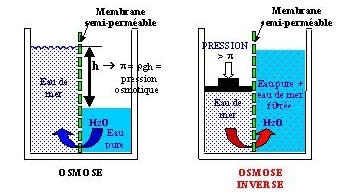
Si on fournit de l’énergie au système, le phénomène de l’osmose est réversible. En exerçant une pression inverse à la pression osmotique sur la solution la plus concentrée, l’eau uniquement retraversera la membrane en sens inverse: c’est l’osmose inverse.
Si seule l’eau d’une solution chargée en sel et en matières organiques traverse la membrane semi-perméable, on obtient un système de filtration ultra efficace.
En imaginant une eau de ville à épurer pour la stérilisation, envoyée contre une membrane semi-perméable au travers d’une pompe de mise en pression supérieure à la pression osmotique, à la sortie de l’osmoseur inverse, l’eau est débarrassée de ses impuretés. Cependant, à force d’épurer l’eau, la concentration en solutés en amont de la membrane augmente et risque d’empêcher l’eau de passer au travers. Pour cette raison, il est nécessaire de créer une fuite contrôlée vers l’égout de manière à réduire la concentration des solutés.
Généralement, on emploie les termes suivants :
- l’alimentation est la solution à épurer;
- le perméat est la solution qui traverse la membrane;
- le concentrat est le rejet.
Technologie de l’osmoseur inverse
Avant toute chose, il est utile de préciser que dans le but de préserver l’osmoseur inverse et de “dégrossir” le travail, on trouve en amont un adoucisseur permettant de réduire la concentration en ions calcium et magnésium de l’eau.

Sans rentrer dans les détails l’osmoseur inverse se compose principalement :
En amont des membranes
- d’un filtre d’entrée;
- d’un pressostat de sécurité;
- d’un manomètre pour le réglage de la pression;
- d’un pompe de mise en pression des membranes;
- de membranes travaillant en alternance:
- d’un contrôle des débits de perméat et de concentrat
- d’un contrôle des pressions
En aval des membranes
- d’un contrôle du débit de concentrat;
- d’un conductimètre (mesure la qualité de l’eau en µSiemens);
Les membranes


Pour la petite histoire, l’abbé nollet avait déjà observé à la fin du 17ème siècle qu’une membrane constituée d’une vessie de porc laissait passer un flux d’eau douce pour diluer une solution saline séparée de celle-ci par la membrane; probablement la première observation du phénomène d’osmose.
Depuis, la technique a quand même évolué et la venue des matières synthétiques sur le marché a permis de réaliser des membranes semi-perméables de manière industrielle.
On distingue plusieurs types de membranes :
- Isotropes, où les propriétés structurelles sont constantes sur toute l’épaisseur de la cartouche.
- Anisotropes, où les propriétés structurelles varient sur l’épaisseur de la cartouche.
- Liquides.
En fonction de la nature des matériaux constituant les couches des membranes, on parle de :
- Membranes organiques fabriquées à partir de polymères organiques tels que l’acétate de cellulose, de polyamides, …
- Membranes minérales constituées de matériaux tels que les matières céramiques, le métal fritté et le verre. Ces matériaux résistent bien aux hautes températures et aux agressions chimiques.
- Membranes composites caractérisées par la structure asymétrique d’une peau très fine et constituées de plusieurs couches différenciées par leur nature physico-chimique (organique, organo-minérale ou minérale).
- Membranes échangeuses d’ions.
Suivant la géométrie des supports (modules) de ces membranes, on trouve sur le marché :
- Les modules tubulaires qui utilisent une technologie simple, facile d’utilisation et de nettoyage mais de compacité réduite où la consommation d’énergie est important pour un faible débit de perméat.
- Les modules composés d’un ensemble important de fibres creuses (grand débit de perméat).
- Les modules plans où les membranes sont empilées à la manière d’un “mille-feuilles” séparées par des cadres intermédiaires qui assurent la circulation des fluides. On retrouve souvent dans les installations d’osmose inverse des modules spiralés.
La conductivité de l’eau
La conductivité électrique d’une eau correspond à la conductance d’une colonne d’eau comprise entre deux électrodes métalliques de 1 cm² de surface et séparées l’une de l’autre de 1 cm. L’unité de conductivité est le micro-siemens par centimètre (µS/cm). La conductivité traduit la minéralisation totale de l’eau. Sa valeur varie en fonction de la température. Elle est donnée à 20°C. Sa mesure permet de déceler immédiatement une variation de la composition de l’eau, par exemple :
- Baisse de conductivité de l’eau d’un réseau de chauffage due à l’entartrage.- Réglage de la purge d’une chaudière ou d’un circuit de refroidissement pour limiter la concentration des sels dissous.
- Contrôle de la production d’une chaîne de déminéralisation. Approximativement, la valeur en µS/cm correspond à la salinité en mg/l. On utilise également la résistivité, inverse de la conductivité, mesurée en ohms.cm : Résistivité (ohms.cm) = 1 000 000 / conductivité (en µS/cm)
Niveau guide de la conductivité à 20°C d’une eau destinée à la consommation humaine : 400 µS/cm
- < 15 : qualité de l’eau de stérilisation;
- 50 à 400 : qualité excellente;
- 400 à 750 : bonne qualité;
- 750 à 1500 : qualité médiocre mais eau utilisable;
- > 1500 : minéralisation excessive.



![Adoucisseur d’eau [Stérilisation]](https://energieplus-lesite.be/wp-content/uploads/2007/09/sterilisation-02-500x383.jpg)

Auteur : les anciens
Mars 2009 : Thibaud
Notes :
16/03/09, par Julien :
Avril 2009, Sylvie :
Mai 2009