Sommaire

Principe
Les éléments de base constituant une pile à combustible sont principalement au nombre de trois, à savoir :
- une électrode de type anode émettrice d’électrons (oxydation);
- une électrode de type cathode collectrice d’électrons (réduction);
- un électrolyte séparant les deux électrodes.
Pour certains types de pile, l’injection continue d’un combustible au niveau de l’anode (H2 par exemple) induit, en présence de platine, la réaction d’oxydation catalytique :
H2 → 2H+ + 2e–
De par ses propriétés physico-chimiques, l’électrolyte est “perméable” aux ions H+, ce qui leur permet de migrer vers l’électrode cathodique. Dans un même temps, l’électrolyte est aussi “imperméable” aux électrons et leur impose de passer par un circuit conducteur externe à la pile. D’où la création d’un courant électrique si le circuit est fermé.
L’injection continue de dioxygène de l’air (ou oxygène de l’air en simplifiant) au niveau de la cathode induit, aussi en présence de platine, la réaction suivante de réduction catalytique :
½ O2 + 2H+ + 2 e– → H2O + Q (chaleur)
L’effet escompté est assuré puisque la réaction physico-chimique dans son ensemble produit de l’électricité aux bornes des électrodes et de la chaleur.
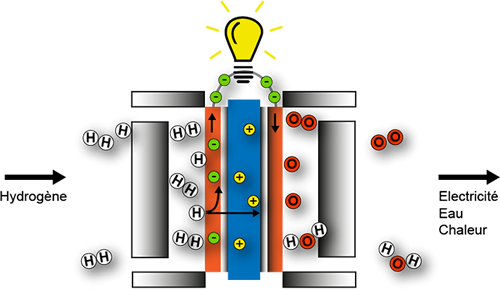
En première approche, cette technologie est propre vu qu’une pile alimentée avec de l’hydrogène et de l’oxygène rejette de l’eau. Le seul hic est que la production d’hydrogène, à l’heure actuelle, est très énergivore et potentiellement polluante.
Les piles à combustible sont caractérisées par la nature de l’électrolyte :
- Un électrolyte acide induit une migration d’ions positifs (H+) de l’anode vers la cathode.
- À l’inverse, un électrolyte basique génère la migration d’ions négatifs (OH–, O2-, CO32-) de la cathode vers l’anode.
Les types de pile à combustible
Piles à combustible à électrolyte acide
- Les PEMFC (Proton Exchange Membrane Fuel Cell). L’électrolyte est constitué d’une membrane solide polymère. Les températures de fonctionnement sont basses (20 – 100 °C).
- Les DMFC (Direct Methanol Fuel Cell). À la place de l’hydrogène, les piles utilisent comme combustible le méthanol (CH3OH). Injecté directement sur l’anode avec de l’eau son oxydation catalytique produit des ions H+ et du gaz carbonique. Comme sur les PEMFC, une membrane solide polymère constitue l’électrolyte et permet la migration des H+ vers la cathode.
- Les PAFC (Phosphorique Acid Fuel Cell) utilisent comme électrolyte l’acide phosphorique liquide emprisonné dans une matrice solide poreuse. Elles peuvent fonctionner jusqu’à 200 °C.
Piles à combustible à électrolyte basique
- Les AFC à potasse liquide (Alkaline Fuel Cell) utilisent l’ion OH– libéré par réduction catalytique de cette base sur la cathode.
- Les MCFC (Molten Carbonate Fuel Cell) utilisent des carbonates de lithium et de potassium fondus pour la migration des ions CO32-.
- Les SOFC (Solid Oxyde Fuel Cell) sont à base d’un électrolyte solide (zircone dopé aux terres rares) afin de produire des ions O2-.
Le catalyseur aux électrodes
Les enjeux énergétiques
Les piles à combustible présentent beaucoup d’atouts comme, par exemple :
- des rendements élevés;
- silencieuses;
- sans pièce mobile;
- dans une gamme de température large;
- d’un point de vue environnemental, ne produit que de la chaleur et de l’eau.
Cependant, le défi est de taille pour produire de l’hydrogène. À 95 %, l’hydrogène est issu du “reformage” à la vapeur (ou vaporeformage) de combustibles fossiles comme le gaz de ville, le butane, le propane, … avec émission importante de CO2.
La réaction générale s’écrit :
CnH(2n+2) + nH2O → nCO + (2n+1)H2
Exemple avec n = 1 : CH4 + H2O → CO + 3H2
Il est nécessaire de neutraliser le CO. Une réaction seconde permet d’y arriver :
CO + H2O → CO2 + H2
Du CO2 est donc émis !
En termes de rendement global théorique, des annonces de 95 % pour des piles à combustible domestique sont avancées au niveau de programme européen ene.field : ![]() http://enefield.eu/
http://enefield.eu/
À prendre donc en considération, mais avec des “pincettes”.
Le module sur la cogénération à été réalisé par l’ICEDD, Institut de Conseil et d’Etudes en Développement Durable asbl – © ICEDD – icedd@icedd.be



Notes :